Prof.Dr.Ahmet Dobrucalı
Bu yazıda gastroözofagial reflü hastalığı ile ilgili olarak aşağıda sıralanan soruların yanıtları verilmeye çalışılacaktır;
– Gastroözofagial reflü hastalığı nedir, toplumda hangi sıklıkta görülür?
– Hastalığın oluşmasına yol açan sebepler nelerdir?
– Gastroözofagial reflü hastalığının tipik ve atipik belirtileri nelerdir?
– Teşhisde hangi yöntmeler kullanılmalıdır?
– Gastroözofagial reflü hastalığının komplikasyonları nelerdir? Bu hastalıkta özefagus kanseri görülme sıklığı artarmı?
– Gastroözofagial reflü hastalığı nasıl tedavi edilir? Reflü tedavisinde kullanılan ilaçların uzun süre kullanılmasının sakıncaları varmıdır?
– Gebelerde gastroözofagial reflü hastalığının tedavisi nasıl olmalıdır?
– Gastroözofagial reflü hastalığının tedavisinde endoskopik yöntemlerin yeri nedir?
– Gastroözofagial reflü hastalığında cerrahi tedavi ne zaman uygulanmalıdır?
Gastroözofagial reflü hastalığı (GÖRH) nedir, toplumda hangi sıklıkta görülür?
Gastroözofagial reflü (GÖR) mide içeriğinin özefagusa geri kaçmasıdır. Aslında GÖR özellikle yemek sonrasındaki dönemlerde ve uykunun REM fazında (rapid eye movement) olmak üzere gün içinde 10-50 kez kadar olabilen fizyolojik bir olaydır. Fizyolojik GÖR kısa sürdüğünden dolayı farkına varılmaz veya çok hafif semptomlar oluşturabilir. Ancak GÖR gün içinde sık aralıklarla tekrarladığında, uzun sürdüğünde ve özellikle uyku sırasında oluştuğunda artık patolojik GÖR sözkonusudur ki bu tablo genellikle özefagus mukozasında değişik derecelerde olabilen hasarlanma ve çeşitli semptomlarla birliktedir. Bu durumda gastroözofagial reflü hastalığından (GÖRH) bahsedilir. Özefagusda endoskopik ve/veya histopatolojik yöntemlerle saptanabilen bir hasarlanmanın varlığı ise reflü özofajiti olarak adlandırılır. GÖRH oldukça sık görülen bir hastalık olmasına rağmen (Toplumun yaklaşık %20 si) hastaların çoğu basit diyet değişiklikleriyle veya antasitlerle sağladıkları geçici semptomatik düzelme nedeniyle hekime müracaat etmezler. Bu nedenle klasik kitaplarda GÖRH nın toplumdaki yeri bir buzdağına benzetilmiştir. Hekime müracaat eden vakaların tüm hastaların ancak %10-15 ini oluşturduğu düşünülmektedir. Kronik ve sık nükseden vakalar genellikle gastroenterologlar tarafından görülürken daha az semptomatik olan vakalar genellikle pratisyen hekimlerce izlenmekte, hafif semptomları olanlarsa hekime müracaat etmemektedir. GÖRH nın en tipik bulgusu olan retrosternal yanma hissinin (Heartburn) toplumdaki sıklığı oldukça yüksektir. Batı ülkelerinde insanların %50 sinin yılda en az bir kez, %25 inin ayda en az birkez %10 unun haftada en az bir kez ve % 5 ninde her gün heartburn tanımladıkları saptanmıştır. Ülkemizdeki epidemiyolojik çalışmalarda elde edilen bulgular da bu sonuçlardan pek farklı değildir. Heartburn sıklığı coğrafi bölgelere göre değişiklik gösterir, Avrupa ve Kuzey Amerika’da daha sık rastlanırken Afrika’da seyrek görülmektedir. Gebe kadınlarda özellikle 2 ve 3. trimestrde sık görülür. GÖRH kadın ve erkeklerde eşit sıklıkta görülmesine rağmen GÖRH nın bir komplikasyonu olan Barrett metaplazisi erkeklerde daha sık görülmektedir. GÖRH nın sıklığı ve komplikasyonlarının görülme oranı ve şiddeti yaşlanma ile artmaktadır. Herhangi bir sebepten dolayı üst gastrointestinal sistem endoskopisi yapılan insanlarda rastlantısal olarak özofajit görülme oranı %2-5 civarındadır. GÖRH semptomları ile endoskopik bulgular arasında her zaman güçlü bir korelasyon olmayabilir. Semptomatik GÖR hastalarının ancak yarıdan az bir kısmında (%30-40) endoskopide özofajit bulgularına rastlanmaktadır (1,2,3,4).
GÖRH nın oluşmasına yol açan sebepler nelerdir?
Bugünkü bilgilerimize göre GÖRH nın patogenezinde birden fazla faktör rol oynamaktadır. Patolojik gastroözofagial reflünün meydana gelmesinden reflüye karşı koruyucu ve reflüyü kolaylaştırıcı mekanizmalar arasındaki dengenin bozulması sorumlu tutulur. Mideden özefagusa kaçan mide içeriğindeki en zararlı madde mide asididir. Ancak asitle birlikte safra ve pankreas enzimlerinin de bulunması özefagustaki hasarlanmanın şiddetini artırmaktadır. Aksine tükrük bezlerinden salgılanan tükrük, içerdiği bikarbonat ve büyüme faktörleri nedeniyle özefagus mukozasını reflünün zararlı etkisinden koruyucu etkiye sahiptir. Özefagus mukozasının aside duyarlılığı her insanda farklı olduğundan aynı şiddette aside maruz kalma sonrasında özefagusta oluşan hasarlanmanın derecesi ve semtomların şiddeti de değişik olmaktadır(1,5,6).
Alt özefagus sfinkteri:
(AÖS) AÖS normal insanlarda 15-40mmHg arasında değişebilen bir istirahat basıncına sahiptir. Yutkunma ile birlikte gıdaların özefagusdan mideye geçişini sağlamak amacıyla AÖS basıncı düşer ve 3-6 sn. kadar düşük kaldıktan sonra tekrar istirahat basıncına ulaşır. AÖS basıncı nörojenik, miyojenik ve humoral mekanizmaların kontrolü altındadır. Yağlı yiyecekler,sigara,bazı ilaçlar (kalsiyum kanal blokerleri, beta adrenerjik blokerler, nitratlar ve antikolinerjikler ) sfinkter basıncını düşürürler. AÖS nin istirahat basıncının düşüklüğü ile özofajitin şiddeti arasında doğru bir orantı olduğu gösterilmiştir. AÖS basıncı 10mmHg nin altında olması halinde reflü sıklığı artarken basıncın 5mmHg altına düşmesi hemen her zaman gastroözofagial reflü ile birliktedir. AÖS basıncının genelde çok düşük olduğu sklerodermada özofajit görülme sıklığı artmıştır. Normalde AÖS basıncı diurnal bir ritm gösterir, geceleri uyku sırasında basınç daha yüksek, yemek sonrasında daha düşüktür. Fizyolojik reflü gün içinde ve özellikle postprandial peryodda olurken nokturnal reflü görülmez. GÖR hastalarının %60-70 inde noktürnal reflü bulunur. AÖS yutkunma olmadan da özellikle yemek sonrası dönemde ve uykunun REM fazında olmak üzere kısa süreli olarak (genellikle <5dk) gevşeyebilir. Normal insanlarda gün içinde saatte 1-4 kez kadar olabilen bu olay (ortalama 50-60 / 24 saat) AÖS nin geçici gevşemeleri olarak adlandırılır ve normal insanlardaki fizyolojik reflünün hemen tamamından sorumludur (Transient lower esophageal sphincter relaxation-TLESR). AÖS postprandial peryod dışında günün diğer vakitlerinde ve uykunun REM fazı dışındaki diğer dönemlerinde de gevşeyebilir ki bu durum AÖS nin uygun olmayan geçici gevşemeleri olarak adlandırılır ve GÖRH daki patolojik reflüden daha çok bu mekanizmanın sorumlu olduğu kabul edilmektedir (Inappropriate transient lower esophageal sphincter relaxation- ITLESR). TLESR oluşumunu tetikleyen mekanizma tam olarak bilinmemekle birlikte kardianın gerilmesi ile uyarılan mekanoreseptörlerin ve kolesistokinin, nitrikoksit, VİP (vazoaktif intestinal peptit) gibi nonadrenerjik ve nonkolinerjik mediatörlerin rol oynadığı düşünülmektedir. Son yıllarda yapılan çalışmalarda GABA-ß (Gamma-aminobütirik asit-beta) reseptörlerinin önemli rol oynadığı gösterilmiştir. Bir GABA agonisti olan Baclofen (Lioresal) nin postprandial TLESR ve reflü epizodu sayısını ve özefagusun aside maruz kalma süresini %40 oranında azalttığı gösterilmiştir. Özefagus ve midenin birleşme bölgesi ve özefagusun anatomisi
Normal insanlarda ve GÖRH da gastroözofagial reflü aşağıda belirtilen üç değişik mekanizmadan biri ile oluşur (5,6);
1-AÖS nin geçici gevşemeleri ile birlikte olan spontan reflü (Bkz. TLESR ve ITLESR)
2-Karın içi veya mide içi basıncın artmasına bağlı reflü (Karın duvarı kaslarının kasılması, gebelik, ascites, pilor stenozu vb.)
3-Devamlı düşük sfinkter basıncı nedeniyle oluşan serbest reflü (hipotonik sfinkter veya sklerodermada olduğu gibi).
AÖS basıncı düşük olan hastalarda karın içi basıncın arttığı anlarda, postür değişikliklerinde veya spontan olarak gastroözofagial reflü oluşabilir.
Diafram ve hiatus hernisi:
Sağ diafram krusu AÖS nin üst yarısını bir halka şeklinde çevreleyerek adeta bir eksternal sfinkter gibi rol oynar. Kayan tipte (sliding) hiatal herni varlığında diaframın bu fonksiyonu kaybolur. Bunun dışında özefagusun mide ile oblik bir eksende birleşmesi (His açısı), özefagus ve midenin birleşme bölgesindeki mukozal kıvrımlar, alt özefagus sfinkterinin uzunluğu ve özefagusun karın içi basınca maruz kalan intraabdominal segmentinin uzunluğu alt özefagus sfinkterine katkıda bulunan diğer mekanik faktörlerdir. Yapılan çalışmalarda hiatus hernisi olanlarda distal özefagusta peristaltik aktivitenin zayıfladığı, asit klirensinin azaldığı ve TLESR sıklığının arttığı gösterilmiştir. Hiatal herni varlığı her zaman GÖR ile birlikte değildir ancak hiatal herni ile birlikte olan GÖRH genelde daha şiddetli seyreder. GÖR hastalarının yaklaşık yarısında kayan tipte hiatus hernisi bulunurken hiatus hernisi olanların ancak 1/3 inde GÖR saptanmaktadır. Uzun segment Barrett metaplazisi (>3cm) olan hastaların %95 inde ve kısa segment Barrett metaplazisi (<3cm) bulunan hastalarında %70 inde hiatal herni bulurken non-eroziv reflü hastalarının %30 unda hiatal herniye rastlanmaktadır (6).
Özofagial klirens:
GÖRH da mukozal hasarlanmanın şiddeti reflü materyalinin içeriğine ve özefagus mukozası ile temas süresine bağlıdır. Özofagial klirens (temizlenme) mekanizmaları özefagus mukozasının reflü materyaline maruz kalma süresinin kısalmasını sağlar. Sağlıklı bir insanda bir reflü atağından sonra özefagusa kaçan reflü materyalinin klirensi 3-5 dk. lık bir sürede tamamlanır. Özefagusun primer ve sekonder peristaltizmi, yutulan tükrük, özefagusdaki submukozal glandların bikarbonattan zengin sekresyonları ve yer çekimi özefagial klirensi sağlayan başlıca mekanizmalardır. Sekonder peristaltizm özellikle gece uyku sırasındaki klirensi sağlaması bakımından önemlidir. Özofajitin şiddeti ile özefagusdaki peristaltik aktivitenin zayıflığı arasında pozitif bir ilişki olduğu gösterilmiştir. Gastroözofagial reflü hastalarında ‘inefektif özefagus’ olarak adlandırılan ve özefagusdaki peristaltik dalga amplitüdünün 30mmHg nın altında olduğu bir çeşit özefagus motor fonksiyon bozukluğu tanımlanmıştır. Bu bozukluğun altta yatan sebep mi olduğu yoksa özofajite sekonder mi geliştiği tam olarak bilinmemektedir. Tükrük, hem yüksek miktarda bikarbonat ihtiva etmesi sayesinde özefagusa kaçan asidi nötralize etmekte hem de içerdiği epidermal büyüme faktörü (EGF -Epidermal Growth Factor) nedeniyle epitel rejenerasyonunu hızlandırmaktadır (1,2,6,7).
Mukoza direnci:
Özefagus mukozası hem yapısal hem de fonksiyonel özellikleriyle reflünün oluşturacağı hasarlanmaya karşı direnç gösterir ve bu direnç mekanizmaları preepitelial, epitelial ve postepitelial olmak üzere üç ana gurupta incelenebilir. Yapısal bir engel oluşturan epitel yüzeyindeki mukus-bikarbonat-su tabakası, hücre mebranı ve hücreler arasındaki sıkı bileşkeler (zonula okludens-zonula adherens) preepitelial savunma mekanizmaları olup H+ iyonlarının intersellüler aralığa difüzyonuna engel olmak suretiyle etki gösterirler. Özefagusdaki preepitelyal defans mide ve duodenumdaki benzer yapıdan çok daha zayıftır. Preepitelyal defansın özefagusta zayıf oluşu luminal asiditenin direkt olarak yüzey epiteline ulaşması demektir ki bu da peptik ülserli hastaların aksine GÖRH da tedavide kullanılan ilaçların neden daha yüksek dozda ve daha sık aralıklarla alınması gerektiğini bir ölçüde açıklayabilir. Hücre içi ve hücre dışındaki tampon sistemleri (proteinler, HCO3, PO4-3, karbonik anhidraz enzimi) ve H+ iyonunun hücre dışına atılmasını sağlayan iyon değiştirici sistemler (bazolateral membran Na+/H+ ve Na a bağımlı Cl-/HCO3 pompası) ve epitel regenerasyonu gibi özellikler epitelial savunma sistemleri dir. Mukoza için gerekli olan oksijen, HCO3 ve diğer maddelerin mukozaya ulaşmasını ve H+, CO2 ve diğer metabolik artıkların mukozadan uzaklaştırılmasını sağlayan mukoza kan akımımı ise postepitelial defans sistemini oluşturur. Sigara, alkol, çok sıcak içecekler, yüksek oranda tuz ve baharat içeren hipertonik gıdalar, tetrasiklin, doksisiklin, C vitamini, bifosfonatlar (alendronate) ve KCl gibi ilaçlar özefagus mukozasının aside direncini azaltabilirler (1,2,5).
Mide boşalım hızı:
Teorik olarak, gecikmiş mide boşalımının gastroözofagial reflüyü artırabileceği düşünülebilir. Artan gastrik volüm TLESR sıklığını ve gastroözofagial basınç farkını artırarak gastroözofagial reflüyü artırabilir. Bazı çalışmalarda GÖR hastalarının yaklaşık 1/3 inde katı maddelerin mideden boşalımında gecikme olduğu saptanmışsa da bu konu halen tam olarak açığa kavuşmamıştır. Mide boşalımı belirgin olarak gecikmiş olan reflü hastalarında tıbbi ve/veya cerrahi tedaviye cevap yetersiz olabilir. Mide ve duodenum tümörleri, duodenuma dışardan bası yapabilecek tümörler, peptik striktüre yol açmış duodenum ülserleri ve şiddetli gastroparezide de tedaviye dirençli gastroözofagial reflünün bulunabileceği unutulmamalıdır (1,5).
Reflü materyalinin toksisitesi:
Özofagusa kaçan mide içeriğindeki zararlı maddeler arasında HCL, pepsin, konjuge ve nonkonjuge safra tuzları ve tripsin gibi pankteatik enzimler sayılabilir ancak bunlar içinde en önemlisi ve en zararlı olanı HCL dir. GÖRH da özofajitin şiddeti özefagusun aside maruz kalma süresi ile doğrudan ilişkilidir. Bu ilişkiye rağmen hastaların ancak bir bölümünde mide asit sekresyonu artmıştır. Mide asit sekresyonunun çok fazla olduğu Zollinger Ellison sendromunda reflü özofajiti sık görülür. Pepsin GÖRH da HCL le oluşan hasarlanmayı artırıcı rol oynamaktadır ancak bunun ne derece etkin olduğu tam olarak belirlenmiş değildir. Asit salgilanmasını baskılayan ilaçlar indirekt olarak pepsin aktivitesini de azaltmaktadır. Normalde safra tuzlarının mide suyundaki konsantrasyonu 0.05-0.5mM/L arasında değişebilen ve toksik olmayan seviyelerdedir. Özefagus mukozası için sitotoksik olan seviyeler 5mM/L ve üzeridir. Bununla birlikte toksik olmayan dozlardaki safra tuzları asidik pH da özefagus epiteli içinde birikerek sitotoksik konsantrasyona ulaşabilirler. Mide ve özefagusda safra asidi ve biluribin varlığının kalitatif ve kantitatif olarak ölçümüne olanak sağlayan ambulatuar tekniklerin (Bilitec) kullanılmasıyla bu konudaki bilgiler giderek artmaktadır. Yapılan çalışmalarda reflü materyali içindeki safra asidi miktarı ile özofajitin şiddeti arasında doğru bir ilişki bulunduğu, safra reflüsü belirgin olanlarda striktür ve Barrett metasplazisi gelişiminin daha sık olduğu anlaşılmıştır (Double reflux – double trouble)(1,5,7,8).
Helicobacter pylori (Hp):
Duodenum ülserli hastalarda Hp eradikasyonu yapılmasından sonra GÖRH sıklığının arttığını, Barrett metaplazisi gelişen GÖR hastalarında Hp enfeksiyonu sıklığının daha az olduğunu ve özellikle batı toplumunda Hp enfeksiyonu sıklığındaki azalmayla birlikte GÖRH insidansının arttığını bildiren yayınlardan sonra midedeki Hp enfeksiyonunun GÖRH na karşı koruyucu bir rolü olabileceği düşünülmeye başlanmıştır. Bugün için bu konuda kesin bir görüş birliği yoktur. Hp enfeksiyonu varlığında mide asidinin uzun süreli olarak baskılanması enfeksiyonun şiddetlenmesine, antrumdan korpusa doğru yayılmasına ve sonuçta atrofik gastrit gelişimine yol açabileceğinden uzun süreli tedavi planlanan GÖR hastalarında tedavi öncesinde Hp eradikasyonu yapılması uygun bir yaklaşım gibi görünmektedir.
Hp enfeksiyonu ile GÖRH arasındaki olası ilişkiler kısaca aşağıdaki şekilde sıralanabilir (6,7);
1- Hp enfeksiyonunun GÖRH gelişimine karşı koruyucu etkileri: -Mide asit sekresyonunun azalması; Bakterinin mide korpusunda oluşturduğu kronik gastrit sonucunda gelişebilen atrofik gastrit, midedeki M3 reseptör sayısında azalma, IL-1 sekresyonunda artış vb. sebepler nedeniyle mide asit sekresyonu azalabilir. -Mide asidinin nötralizasyonu; Bakteri tarfından sentezlenen amonyak asidi nötralize ederek mide içi pH yı yükseltir.
2-Hp enfeksiyonunu GÖRH oluşumunu kolaylaştırıcı etkileri:
-AÖS istirahat basıncında ve TLESR sıklığında artış; Kardiadaki Hp enfeksiyonu nedeniyle açığa çıkan sitokinler ve prostoglandinlerin etkisiyle AÖS basıncı azalabileceği ve TLESR sıklığında artış olabileceği ileri sürülmüştür.
-Hipergastrinemi ve asit sekresyonunun artması; Antrum ağırlıklı Hp enfeksiyonu sırasında antrumdaki gastrin salgılayan G hücrelerinin uyarılması ve somatostatin salgılayan D hücrelerinin sayı ve fonksiyonunun azalması mide asit sekresyonunu artırabilir.
-Mide boşalımında gecikme(?); Hp enfeksiyonu sırasında mide boşalımında gecikme olduğu bazı çalışmalarda gösterilmişse de daha sonra yapılan çalışmalarda bu bulgular desteklenmemiştir.
-Özefagus mukozasında hasarlanma ve mukozanın aside duyarlı hale gelmesi; Kardia ve distal özefagusta kolonize olabilen bakteri tarafından oluşturulan sitotoksinler,fosfolipaz ve amonyağın özefagus mukozasını asit etkisine duyarlı hale getirebileceği düşünülmüştür.
GÖRH nın erken histopatolojik bulguları nelerdir?
Reflü özofajitinin en erken histolojik bulgusu özefagus epitelinde intersellüler aralıkların genişlemesidir ve ancak elektron mikroskopu ile tesbit edilebilir. Bu durum GÖRH da özefagus epitelinde H+ iyonuna karşı parasellüler geçirgenliğin arttığını gösteren bir bulgudur. Işık mikroskopu ile saptanabilen erken bulgular ise özefagus epitelde bazal tabakada hiperplazi, papillalarda uzama ve hafif eozinofil infiltrasyonudur. Özofajitin şiddeti arttıkça inflamasyonun diğer bulguları olan ödem, polimorf nükleer ve eozinofil hücre infiltrasyonu, vasküler konjesyon, ekstravazasyon, epitel nekrozu, epitel kaybı ve ülserasyonlar görülmeye başlar. Eozinofilik hücre infiltrasyonunun belirgin olması (>20 eozinofil/bir büyük büyütme alanı) GÖRH ile aynı semptomları verebilen bir hastalık olan eozinofilik özofajiti düşündürmelidir. Kronik vakalarda ise mononükleer hücre infiltrasyonu (makrofajlar) ve fibroblast proliferasyonu dikkat çeken histolojik bulgulardır (8,9).
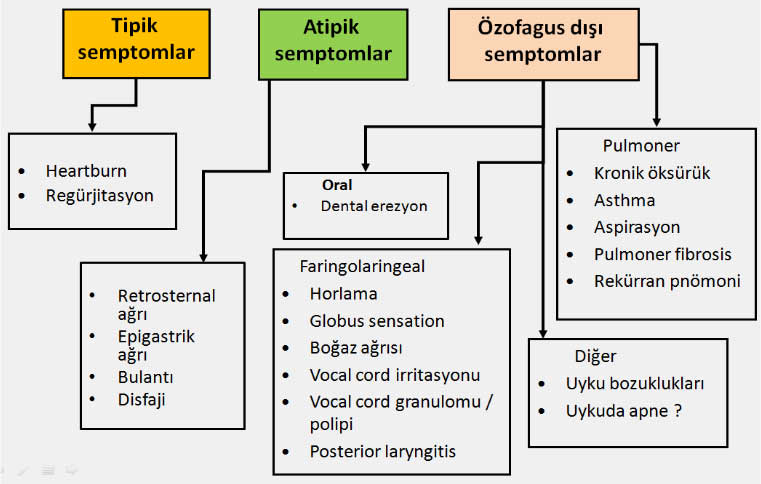
GÖRH nın tipik ve atipik belirtileri nelerdir?
Tipik GÖRH da hastalığa ait semptomlar uzun süreden beri var olup genellikle aralıklı bir seyir izler. GÖRH nın klasik semptomları ‘heartburn’ veye pirozis (pyrosis) olarak adlandırılan ve sternum arkasında duyulan yanma hissi ve daha seyrek olarak görülebilen regürjitasyondur. Pyrozis genellikle yemek sonrası dönemlerde ve öne eğilmekle veya sırtüstü yatma ile artar ve antasit alımı ile şiddetini kaybeder. Yemek sonrasında alınan gıdaların mide asidini nötralize etmesi nedeniyle mide içi pH yükseldiği halde heartburn sıklığının artması düşündürücüdür. Yapılan çalışmalarda yemek sonrasında korpus ve antrumda pH yükseldiği halde kardiada bir müddet daha pH nın düşük kaldığı görülmüş (kardiadaki asit cebi) ve erken postprandial dönemde oluşan reflü semptomlarından bu asit cebindeki asidin özefagusa kaçması sorumlu tutulmuştur. Bazı bayan hastalar cinsel birleşme sırasında pirozis oluştuğundan yakınabilirler (reflux dyspareunia). Diğer bir semtom olan regürjitasyon postüral karakter gösterebilir. Akalazya veya mekanik obstrüksiyonda görülenin aksine GÖRH da regürjite olan materyal sindirilmiş gıdalar ve mide asidinden oluşan acı-ekşi tattaki mide muhtevasıdır. Bazı hastalar pyrozisle birlikte ağızlarının tuzlu ve berrak bir sekresyonla dolduğundan şikayetçi olabilirler. ‘Waterbrash’ olarak adlandırılan bu durumun özofagusa asit reflüsü sırasında refleks olarak tükrük sekresyonunun artmasından kaynaklandığı kabul edilmektedir. Ağrılı yutma (odinofaji) şiddetli özofajiti olan hastalarda görülebilirse de infeksiyöz özofajitlerde ve ilaçlara bağlı özofajitte daha sık rastlanan bir bulgudur. Yutma zorluğu (Disfaji) GÖRH da seyrek görülen bir belirtidir. Bazen özefagusun motor fonksiyon bozuklukları GÖRH na eşlik edebilir veya reflü özefagusda spazm vb. motor fonksiyon bozuklukları oluşturabilir. Bu tür hastalarda disfaji hastalığın ilk dönemlerinden itibaren reflüye eşlik eden bir semptom olabilir. Ancak, uzun süreden beri reflü şikayetleri olan bir hastanın disfajiden şikayetçi olmaya başlaması peptik striktür veya özefagus kanserini akla getirmelidir. Kanama seyrek olarak GÖRH nın ilk bulgusu olabilirse de daha çok kronik gizli kan kaybı şeklindedir ve özellikle yaşlılarda demir eksikliği anemisine yol açabilir (9,10). Bu klasik semptomlar dışında GÖRH da bazı atipik semptomlar da bulunabilir. Atipik semptomlar arasında üst solunum yollarına ait olanlar ve özellikle astım ve kronik öksürük en sık görülenlerdir. Pediatrik yaş gurubunda solunum yolarına ait semptomlar daha belirgin olabilir.
Astımlı bir hastada reflü semptomları olduğunda, astım allerjik bir nedene bağlanamıyorsa, gece gelen astım krizleri belirginse ve hastada klasik astım tedavisine yeterli yanıt alınamıyorsa etyolojide GÖRH düşünülmelidir. GÖRH nın astıma sebep olmasında başlıca iki mekanizma suçlanmaktadır; Bunlardan mikro aspirasyon teorisine göre özefagusa kaçan reflü materyalinin aspirasyonu sonucunda oluşan irritasyon astım krizlerine sebep olmaktadır. Diğer teoriye göre ise reflü oluştuğunda özefagusdaki irritasyonun embriyolojik olarak özefagus gibi ön barsaktan oluşmuş olan bronşlarda refleks yolla spazm ve sekresyon artışına sebep olması ve bu şekilde astım krizini başlatmasıdır. GÖRH da rastlanabilecek diğer bir atipik semptom da non-kardiak göğüs ağrısıdır (Non-cardiac chest pain). Anjina pektoris tipinde ağrı tanımlayan hastaların %25-30 kadarında göğüs ağrısını açıklayacak bir sebep bulunamaz ve bu hastaların yarısına yakın bir kısmında ağrıdan GÖR veya özefagusun motor fonksiyon bozukluğu sorumludur (11,12,13)
Gastroözofagial reflü hastalığında tipik ve atipik bulgular
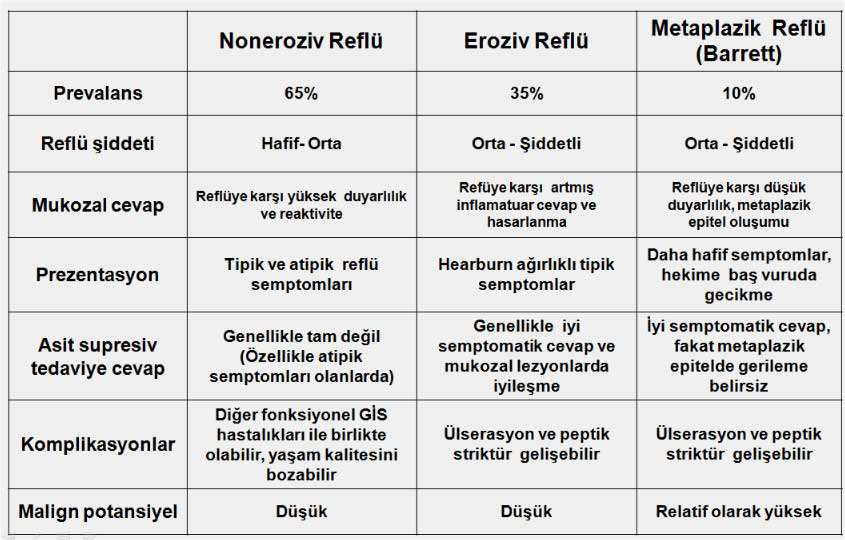
Bugünkü bilgilerimize göre GÖRH nı üç ana guruba ayırmak münkündür;
1-GÖR hastalarının yarıdan fazlasında (%60-70) reflü semptomları olduğu halde endoskopide reflü bulguları saptanmaz. Bu durum endoskopi negatif GÖRH (non-erosive reflux disease, NERD) veya semptomatik GÖRH (symptomatic gastroesophageal reflux disease, S-GERD) olarak adlandırılır. Bu hastalarda pH monitorizasyonu bulguları patolojik sınırlarda bulunduğunda mikroskopik eroziv reflü hastalığı’ndan bahsedilir. Noneroziv reflü hastalığında 24 saatlik pH monitorizasyonu bulguları fizyolojik sınırlarda olduğunda semptom-reflü birlikteliği değerlendirilir. Semptomlar reflü atakları ile uyum gösterdiğinde hasta GÖR hastası olarak kabul edilirken semptom-reflü uyumu olmaması halinde fonksiyonel heartburn dan bahsedilir.
2-Endoskopik bulguları olan GÖRH (erosive gastroesophageal reflux disease, E-GERD).
3-Distal özefagus mukozasında metaplazik değişikliklerle (Barrett) birlikte olan GÖRH (M-GERD), (14,15,16,17).
Gastroözofagial reflü hastalığında alt gurup özellikleri
GÖRH nın teşhisinde kullanılan yöntemler nelerdir?
Dikkatle alınan bir anamnezle tipik semptomları olan hastalarda GÖRH tanısı kolaylıkla konulabilir. Hastanın semptomlarının reflüye yönelik bir tedavi ile kısa sürede düzelmesi de teşhisde kullanılabilecek diğer bir yöntemdir (Test terapötik). Bu tür hastalarda genellikle ilave incelemelerin yapılmasına gerek yoktur. Atipik semptomlar tanımlayan hastalarda, alarm semptomlarının varlığında (Disfaji, odinofaji, belirgin kilokaybı, kanama, anemi vb.) veya tedaviye yanıt vermeyen hastalarda bazı ilave testlerin seçilerek uygulanması gerekir (18,19).
Endoskopi özofagus mukozasının direkt olarak görülmesine ve gerektiğinde histopatolojik inceleme için doku örneği alınmasına imkan vermesi nedeniyle GÖRH teşhisinde en sık kullanılan yöntemdir. Semptomatik GÖR hastalarında endoskopide özofajit bulguları olmayabilir (%60-70), bu taktirde kardioözofagial bileşkenin 3-5 cm proksimalinden biyopsiler alınarak özefagus mukozasının reflünün erken mikroskopik bulguları yönünden incelenmesi tanıda yardımcı olur. GÖR şikayeti ile başvuran bir hastada anamnez yeterli olduğunda genellikle tanı amacıyla endoskopi yapılmasına gerek yoktur. Ancak semptomları en az 5 yıldan beri var olanlarda, 40 yaşın üzerindeki hastalarda , ailesinde özefagus veya mide kanseri bulunanlarda ve alarm semptomlarının varlığında bir kez endoskopi yapılmalıdır. Endoskopide saptanan özofajit şiddetinin derecelendirilmesinde kullanılmak üzere çeşitli evreleme sistemleri geliştirilmiştir. Savary&Miller (veya Savary&Monnier), Los Angeles (LA, The International Working Group for the Classification of Oesophagitis – IWGCO), Hetzel&Dent ve MUSE (metaplazi-ülser-striktür-erezyon) sınıflamaları bunlar arasında sayılabilir. En çok kullanılan Savary-Miller sistemine göre; mukozada hiperemi,ödem veya sadece bir adet longidutinal erezyon ve/veya eksüdatif lezyon (EEL) varlığında 1°, birbirleri ile birleşmeyen birden çok EEL varlığında 2°, lezyonların özefagus lümenini çepeçevre sarması halinde 3°, ülser,darlık veya kısa özefagus gibi kronik lezyonların bulunması halinde 4° ve evre 1-4 deki lezyonlara ilave olarak Barrett özefagusunun bulunması halinde de 5° özefajitten bahsedilir. LA sınıflamasına göre; 5mm den kısa ve mukozal kıvrım üzerinde sınırlanan bir veya daha fazla sayıda lineer erezyon varlığı LA-A, 5mm den uzun ve mukozal kıvrım üzerinde sınırlanan bir veya daha fazla sayıda lineer erezyon varlığı LA-B, mukozal kıvrımlar arasında uzanan veya özefagus lümeninin %75 inden azını kalpayan erezyonların varlığı LA-C ve özefagus lümeninin %75 inden fazlasını kaplayan ve çevreleyen erezyonların varlığı da LA-D olarak değerlendirilir (20,21).
Baryumlu özefagus pasaj grafisinde gastroözofagial reflü, hiatal herni ve peptik darlık gibi bulgular görülebilir ancak özofajitin saptanmasındaki duyarlılığı endoskopiye göre düşüktür. Çift kontrastlı grafiler mukozal hasarlanmanın gösterilmesinde daha duyarlıdır fakat bu yöntem GÖRH nın ciddi bir komplikasyonu olan Barrett özefagusunu gösteremez. Baryumlu özefagus pasaj grafisi çekimi sırasında reflü görülmesi GÖRH için spesifik bir bulgu değildir ve GÖR hastalarının çoğunda da işlem sırasında reflüyü göstermek mümkün olmamaktadır. GÖRH da baryumlu grafide görülebilecek nadir bir bulgu da ‘felinizasyon’ olarak adlandırılan, özefagus lümeninde ince testere dişi görünümündeki halkalanmalardır ve kedi özefagusuna benzediği için bu ad verilmiştir. Sirküler adale tabakasındaki aktivasyona ve hipertrofiye bağlı olduğu düşünülmektedir. Aynı görünüm eozinofilik özofajitte de bulunabilir.
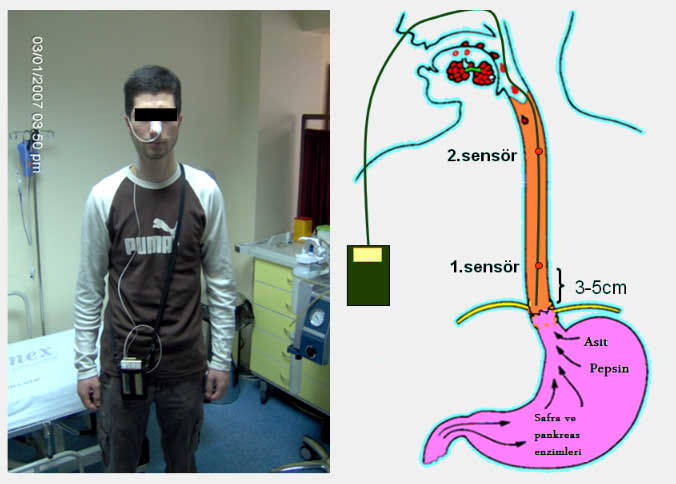
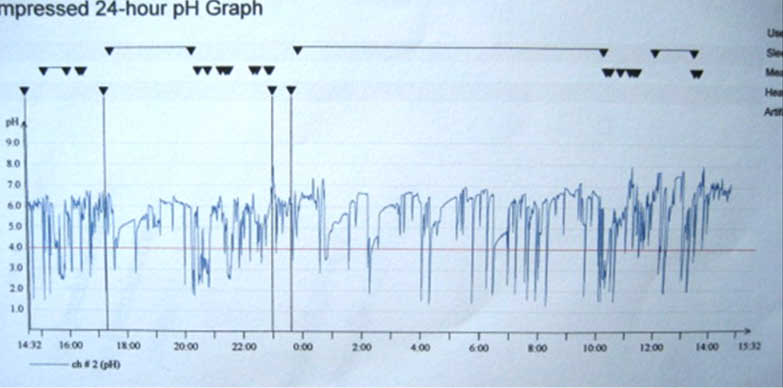
GÖRH düşündüren semptomları olduğu halde endoskopide patolojik bulgu saptanmayan hastalarda teşhisde kullanılacak bir sonraki yöntem uzun süreli (24 veya 48 saat) ‘ambulatuar intraözofagial pH monitorizasyonu‘ dur. Bu yöntemle alt özefagus sfinkterinin 5cm ve 15-20 cm proksimaline yerleştirilen aside duyarlı sensörlerle özefagusun değişik seviyelerindeki pH ölçülerek kaydedilmekte ve daha sonra kompitür progamları vasıtasıyla değerlendirilmektedir. Bu amaçla Johnson ve DeMeester tarafından oluşturulan kriterler kullanılır. Bu kriterlere göre özefagusun aside maruz kaldığı toplam süre (pH<4), reflü epizodu sayısı, 5dk dan uzun süren reflü epizodu sayısı, reflü ataklarının gıda alımı ve pozisyonla olan ilişkisi, uyku sırasında oluşan reflü miktarı, reflü-semptom ilişkisi (semptom indeksi) gibi parametrelere bakılarak hastada GÖRH olup olmadığına karar verilir. Normalde özefagus içindeki pH nın 4 veya üzerinde (pH 6-7) olması gerekir ve pH nın 4 ün altına düşmesi reflü epizodu olarak kabul edilir. Normal bir insanda 24 saatlik sürede özefagus içinde pH 4 ün altında geçen toplam sürenin 60dk nın altında olması (24 saatlik toplam sürenin %4 den azı) ve 5dk dan uzun süren reflü epizodunun bulunmaması gerekir. pH monitorizasyonu patolojik reflünün belirlenmesi yanında hastanın semptomlarının reflü ile ilgili olup olmadığını göstermesi bakımından da ayrı bir öneme sahiptir. Ayrıca tedaviye cevap vermeyen hastalarda tedavinin etkinliğinin araştırılmasında da kullanılabilir. Asit reflüsü yanında safra tuzlarına veya bilürübine duyarlı sensörler kullanılarak (Bilitec®) alkalen reflü varlığı da araştırılabilir. Gastroözofagial reflü hastalarının genellikle özefagusun mekanik ve kimyasal (asit ve safra) uyarımına karşı duyarlılıkları azalmış olmakla birlikte bazı hastalar pH monitorizasyonları normal sınırlarda olduğu halde belirgin ölçüde semptomatik olabilirler. Bu hastalarda uyarı algılama eşiği düşük olup bu durum aşırı duyarlı özefagus (Hipersensitif özefagus, irritabl özefagus, fonksiyonel heartburn ?) olarak adlandırılır. Aksine Barrett özefagusu ve striktür gelişen vakalarda uyarı algılama eşiği genelde yüksektir (20,21).
Ambulatuar pH monitorizasyonu
Özofagial impedans GÖRH tanısında kullanılabilecek bir diğer testtir. Impedans monitorizasyonu sırasına özefagusda proksimalden distale veya distalden proksimale doğru olan bütün hareketler, özefagus içindeki muhtevanın cinsi (katı veya sıvı gıda veya hava yutulması gibi) ve pH sı ölçülebildiğinden reflünün cinsi (asit veya alkalen), yönü ve reflü-semptom ilişkisi hakkında daha doğru ve ayrıntılı bilgi edinmek mümkün olmaktadır. Bu testin kulanılmaya başlamasıyla asit supresiv tedaviye dirençli reflü hastalarının ancak %20 sinde semptomların asit reflüsü atakları ile birlikte olduğu, %40 ında asit olmayan reflü saptanırken %40 ında da reflü veya semptom-reflü ilişkisi bulunmadığı görülmüştür (22,23,24).
Bernstein testinde (Asit perfüzyon testi) nazal yoldan orta özefagusa dakikada 1ml hızla 0.1 N HCl verilir ve semptomların ortaya çıkıp çıkmadığı değerlendirilir. Asit perfüzyonu ile ağrı oluşması ve daha sonra bu ağrını serum fizyolojik perfüzyonu ile kaybolması testin pozitif olduğunu gösterir. Testin duyarlılığı ve özgüllüğü %80 civarında olup negatif bulunması GÖRH olmadığını göstermez (7,25).
Özefageal manometri GÖRH tanısında rutin olarak kullanılan bir yöntem değildir. Manometride alt özefagus sfinkter basıncının 10mmHg altında seyretmesi ve peristaltik dalga şiddetinin 30mmHg ve altında olması reflü potansiyelini göstermesi bakımından anlamlıdır (inefektif özefagus). Anti reflü cerrahi uygulanacak olan hastalarda cerrahi öncesinde özefagus fonksiyonlarının belirlenmesi bakımından mutlaka yapılması gerekir. Son yıllarda pH metrik ve manometrik ölçümleri aynı anda yapabilen ambulatuvar sistemler kullanılmaya başlanmıştır (1,6,25).
Ayırıcı tanıda hangi hastalıklar akla gelmelidir?
GÖRH nın semptomları, infeksiyöz ajanlar, ilaçlar ve kimyasal maddelerle veya radyoterapi sonrasında oluşan özofajitler, Chron, Behçet veya greft versus host hastalığı gibi diğer başka hastalıklarda oluşabilecek özofajitler, eozinofilik özofajit, peptik ülser, fonksiyonel dispepsi, özefagusun motor fonksiyon bozuklukları, safra kesesi hastalıkları ve angina pektorisle karışabilir. Ayrıntılı ve dikkatli bir anamnez genelde yeterli olmakla birlikte bazı hastalarda endoskopi, pH monitorizasyonu, impedans monitorizasyonu, özefagus manometrisi, eforlu EKG ve koroner anjiografi gibi ilave bazı ilave teşhis yöntemlerin kullanılması gerekebilir.
GÖRH nın komplikasyonları nelerdir? Bu hastalıkta özefagus kanseri görülme sıklığı artar mı?
GÖRH nın komplikasyonları aşağıdaki tabloda görülmektedir. Peptik striktür hastaların %4-20 sinde (Ortalama %10) görülür. Genellikle kardiyoözofagial bileşkede veya özefagusun 1/3 alt kısmında oluşur. Peptik striktürün başlıca belirtisi progresiv karakterde olan disfajidir ancak dar bölgede özefagusun çapı 12mm nin altına inmedikçe semptom vermez. Özefagus pasaj grafisi ve endoskopi ile tanı koyulur. Ayırıcı tanıda distal özefagus veya kardia tümörleri düşünülmelidir. Medikal tedavi ile ödem ve inflamasyonun düzeltilmesinden sonra endoskopik balon dilatasyonu denenir. Bu tedaviye cevap vermeyen vakalarda dar bölgeye stent yerleştirilebilir veya cerrahi tedavi uygulanır. GÖR hastalarının %5 den az bir kısmında distal özefagusdaki özofajite ilave olarak bazen şiddetli kanamalara yol açabilen derin ülserler oluşabilir (Wolf ülserleri). Bu ülserler genellikle tıbbi tedavi ile düzelirler. Perforasyon oldukça nadirdir (<%1). GÖRH daki kanama daha çok gizli kan kaybı şeklindedir ve özellikle yaşlı hastalarda kronik demir eksikliği anemisi şeklinde ortaya çıkar. GÖRH kronik larenjit, astım, aspirasyon pnömonisi, atelektazi ve bronşiektazi gibi özefagus dışı komplikasyonlara yol açabilir ve bu durum tıbbi tedaviye cevap vermeyen hastalarda cerrahi tedavi için bir endikasyon oluşturur.
Gastroözofagial reflü hastalığının komplikasyonları Toplumda özefagus kanseri görülme sıklığı coğrafi bölgelere göre değişiklik göstermekle birlikte 1-6/100.000 civarındadır. Yapılan çalışmalar gastroözofagial reflü hastalığı varlığında yemek borusu kanseri görülme sıklığının bir miktar arttığını göstermekteyse de bu artış orta ve hafif şiddetteki reflü vakalarında fazla belirgin değildir. (Reflü şikayeti olmayanlarda %0,002, hafif ve orta şiddette reflüsü olanlarda %0,003-0,018, şiddetli reflüsü olanlarda %0,035). Pratikte bir hastada özefagus kanserinin özofajit, Barrett metaplazisi ve daha sonra kanser gelişimi şeklinde birbirini izleyen dönemlerden birinde yakalanması çok nadir olabilecek bir durumdur. Bugünkü bilgilerimiz, reflü hastalığında yemek borusu kanseri gelişme sıklığında hafif ancak ihmal edilebilir düzeyde bir artış olduğunu göstermektedir ve bu risk cerrahi tedavide görülebilecek ciddi komplikasyonların gelişme olasılığından (%0,5-1,5) belirgin ölçüde daha düşüktür (8,26).
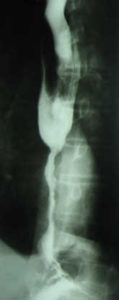
Kronik reflü sonrasında özefagusta oluşan darlığın radyolojik görünümü
Barrett metaplazisi
GÖRH nın şüphesiz ciddi ve sessiz bir komplikasyonu prekanseröz bir hastalık olan Barrett metaplazisinin gelişmesidir. Bilindiği gibi distal özofagusdaki çok katlı skuamöz epitelin yerini metaplazik kolumnar epitelin alması Barrett özofagusu olarak adlandırılır ve genellikle uzun süren GÖRH sonucudur. Uzun süreli aside maruz kalma sonucunda kolumnar epitel metaplazisinin gelişmesi aslında özofagus epitelinin zararlı etkenden (mide asidi) korunmasına yönelik bir adaptasyon mekanizması gibi görünmektedir. Bu metaplazik hücrelerin nereden geldiği sorusu halen cevaplanmış olmamakla birlikte mukozada bulunabilecek kök hücrelerden kaynaklanabileceği düşünülmektedir. Genel olarak endoskopi yapılanlarda Barrett metaplazisine rastlanma sıklığı %0.5-1, GÖRH nedeniyle endoskopi yapılanlarda rastlanma sıklığı ise %5-15 (ortalama %10) dir. Özofagusda peptik striktür varlığında bu oran %50 ye kadar çıkabilir. Özofagusa safra reflüsü varlığında da Barrett metaplazisi daha sık görülmektedir. Barrett özofagusu her yaşta görülebilmesine rağmen 40 yaş sonrasında görülme sıklığı artar. Barrett özofagusundaki metaplazik kolumnar epitelin üç tipi tanımlanmıştır;
1- Kavşak tipi (junctional) olarak adlandırılan ve kardia benzeri hücreler (Kardia tipi),
2- Mide fundusu epiteli benzeri hücreler (Fundik tip)
3- Paneth ve goblet hücreleri varlığı gösteren barsak tipi epitel (İntestinal tip).
Özofagusdaki metaplazik epitel 3 cm den kısa bir segmenti tuttuğunda kısa segment Barrett (short segment Barrett), 3cm den uzun bir segmenti tuttuğunda ise uzun segment Barrett metaplazisinden (long segment Barrett) bahsedilir. 1cm ve daha kısa Barrett metaplazisi genel olarak endoskopi yapılan insanların %10-15 inde görülebildiğinden GÖRH ile ilişkisi tartışmalıdır. Barrett meplazisinde metaplazik alanın tarifinde standart bir uygulama sağlanması amacıyla uygulanmaya başlanan daha yeni bir sınıflama sistemi reflü çalışma gurubu tarafından geliştirilmiş olan C&M Prag sınıflama sistemidir. (WGCO, Working Group for the Classification of Reflux Eesophagitis C&M Prague criteria). Bu sistemde, kolumnar epitelin distal özefagustaki maksimal (M, maximal lenght) ve sirküler tutulum gösteren bölgedeki yükseklikleri (C, circumferential lenght) ölçülerek Barrett metaplazisi sınıflandırılır. Bu sistemde adacık halindeki metaplazik alanlar ayrıca belirtilir (Şekil 13). Bazı hastalarda metaplazik segmentin uzunluğu yılda 0.5-1.5 cm kadar uzama gösterebilir.
Endoskopide Barrett özefagusu saptanan hastalarda yıllık adenokarsinom gelişme prevalansı %0,5 civarındadır. Bu oran Barrett metaplazisi olan hastalarda adenokarsinom gelişme riskinin genel popülasyona göre 30 ila 125 kat daha fazla olduğunu göstermektedir. Kanser gelişimi özellikle intestinal tipte metaplazide belirgindir. Uzun segment Barrett tutulumu olan, alkol ve sigara kullanan, yaşlı ve erkek hastalarda adenokarsinom gelişme riski artmıştır. Barrett epitelinden adenokanser gelişimi intestinal metaplazi-displazi ve insitu kanser evrelerini takiben ortaya çıkar. Displazi, şiddetine göre düşük veya yüksek dereceli displazi (low grade dysplasia-LGD , high grade dysplasia-HGD) ve kesinlik kazanmayan displazi (indefinite dysplasia) olmak üzere üç guruba ayrılır. Barrett metaplazisi olan hastaların 1/3 inde LGD, %5 inde de HGD ye rastlanır. 2 ve 5 yıl süre ile izlenen LGD li hastaların sırasıyla %10 ve %28 inde HGD ye dönüşüm görülür. LGD nin gerileyebildiğine dair bazı veriler olmakla birlikte sonuçlar çelişkilidir ve biyopsi alınma tekniği veya patolojik değerlendirmeden kaynaklanan sorunlar böyle bir sonuç alınmış olmasına yol açmış olabilir. ACG (American College of Gastroenterology) LGD li hastaların bir yıl ara ile endoskopi yapılarak takip edilmesini önermektedir. HGD de kansere dönüşüm sıklığı yıllık ortalama %5 civarındadır. 5 ve 7 yıl süre ile izlenen HGD li hastaların sırasıyla %15 ve %25 inde kanser geliştiği bildirilmiştir. Fokal HGD de %7 oranında kansere dönüşüm görülürken diffüz HGD de bu oran %36 ya çıkmaktadır. HGD li metaplazik mukoza düzgün yapıda olduğunda kansere dönmüşüm oranı %13 ken metaplazik mukoza nodüler yapıda olduğunda bu oran %63’e yükselmektedir. Bu sonuçlar metaplazik mukozanın nodüler yapıda olmasının ve diffüz HGD varlığının kansere dönüşüm riskini artırdığını göstermektedir. Düzgün yapıda mukozada HGD varlığında bir yıl sonunda ilerleme görülmediği taktirde izlemenin bir yıllık aralıklarla sürdürülebileceğini tavsiye eden yayınlar bulunmakla birlikte HGD nedeniyle rezeksiyon yapılan hastaların önemli bir bölümünde (%30-70) patolojik inceleme sırasında kanser saptanması nedeniyle günümüzde HGD saptanan hastaların insitukarsinom olarak kabul edilerek endoskopik veya cerrahi yöntemlerle tedavi edilmesi gerektiği görüşü hakimdir.
Barrett özefagusunda endoskopik takibin amacı kansere dönüşüm bulgularının ve gelişebilecek bir adenokanserin erken ve rezektabl dönemde yakalanabilmesidir. Belirgin endoskopik magnifikasyon sağlayan yeni endoskopik teknikler (NBI-narrow band imaging, high definition endoscopy, confocal endoscopy vb.) metaplazik alandaki şüpheli alanlardan yüksek doğrulukla biyopsi alınmasını sağlayabilmeleri bakımından giderek artan sıklıkta kullanılmaya başlanmıştır. Bu yöntemlerle mukozadaki villüslerde düzensiz yapı ve anormal vaskülarite görülmesi HGD varlığını %95 in üzerinde doğrulukla gösterebilmektedir. Barrett epitelinde kansere dönüşümün erken dönemde tesbit edilmesine yönelik başka yöntemler de mevcut olmakla birlikte bu yöntemler henüz rutin uygulama alanına geçmemiştir. 17. kromozomun kısa kolunda bulunan (17p) p53 geni mutasyonu ve sitometrik yöntemlerle saptanan anöploidi bu amaçla kullanılan yöntemler arasında sayılabilir. Mutasyona uğramış p53 geni yarılanma ömrü uzun olduğundan dokuda birikir ve immunhistokimyasal boyama yöntemleri ile kolayca gösterilebilir. Metaplazik epitelde LGD varlığında %0-10, HGD varlığında %57, adenokarsinom varlığında ise %100 oranında p53 pozitifliği bulunur. p53 negatif olan LGD li hastaların %0-15 inde kanser gelişirken p53 pozitif LGD li hastaların %30-78 inde kansere dönüşüm oluşmaktadır. Bu değişiklikler displazinin histolojik bulgularından önce ortaya çıkarlar ve kansere dönüşümün erken dönemde saptamasında yardımcı olurlar. Dokuda ornitin dekarboksilaz aktivitesi, CEA, mukus yapısındaki anormallikler, c-Ha-ras, c-erb-B gibi onkogenlerin aktivasyonu, hücre büyümesini, bölünmesini ve apoptozu düzenleyen proteinlerdeki değişiklikler (EGF, TGF-alfa, COX-2 vb.) kansere dönüşümü erken dönemde gösterilmesinde kullanılabilen diğer yöntemlerdir.
Aralıklı olarak asite (pH<4) ya meruz kalma Barrett epitelinde hücre proliferasyonunu belirgin ölçüde uyardığından kuvvetli asit supresyonu Barrett özefagusunda tedavinin temelini oluşturur. Barrett özefagusu olan hastalarda metaplazik epitelden alınan biyopsilerin sonucuna göre bir takip ve tedavi şekli uygulanır. Metaplazik epitelden 2 cm ara ile ve her dört kadrandan olmak üzere toplam 8 adet biyopsi alınmalıdır (Seattle protokolü). İnflamasyon ve özofajit bulguları olan hastalarda yüksek doz PPI tedavisiyle düzelme sağlandıktan sonra biyopsi alınmalıdır. Aktif inflamasyon bulguları varlığında displazinin değerlendirilmesi doğru değildir ve yanlış sonuçlara yol açabilir. Histopatolojik incelemede displazi yoksa hastanın PPI tedavisi ile 3 yılda bir endoskopik kontrolü yeterlidir. Hafif derecede displazi saptanan hastalarda PPI tedavisi altındayken ikinci endoskopi ilk yıl 6 ay ara ile tekrarlanmalı ve yine hafif displazi saptanması halinde hasta 1 yıl ara ile endoskopik kontrollere çağırılmalıdır. İki yıl üst üste displazi saptanmayan vakalarda izleme aralığı 3 yıla çıkarılabilir. Ağır derecede displazi saptanan hastalarda yoğun medikal tedavi sonrasındaki 3. ayda endoskopi tekrarlanmalı ve patolojik tanı başka bir patolog tarafından da doğrulandıktan sonra endoskopik veya cerrahi rezeksiyon yöntemlerinden biri uygulanmalıdır . Seçilecek yöntem metaplazik alanın genişliğine, yapısına (nodülarite vb.), hastanın yaşına, genel durumuna, komorbid hastalıkların varlığına, yöntemin uygulanabilirliğine ve hastanın seçimine göre belirlenmelidir. En iyi merkezlerde bile cerrahi rezeksiyonun mortalitesi %4-10, morbiditesi ise %35 civarındadır ve bu oranlar sıradan merkezlerde daha yüksek seviyelerdedir.
Cerrahiye kontrendikasyon teşkil eden durumların varlığında veya endoskopik tedavi için uygun olan vakalarda endoskopik mukozektomi, termal enerji (Lazer, elektrokoagülasyon, argon plazma koagülasyon ve radyofrekans enerji – BARRX) ve fotodinamik tedavi yöntemleri denenebilir. Bunlar arasına en sık kullanılanlar fotodinamik tedavi yöntemleridir. Bu amaçla hastaya ‘hem’ biyosentezinde rol oynayan bir madde olan 5-aminolevulinic acid (5-ALA) veya bir hematoporfirin karışımı olan porfimer sodyum verildikten 4-6 saat sonra metaplazik epitele endoskopik olarak uygulanan laser daha önce epitelde biriken 5-ALA veya porfirini toksik forma dönüştürerek hücre ölümüne yol açar. Bu yöntemlerde başarı %40 ile %90 arasında değişebilen oranlarda bildirilmekle birlikte mortalite %5-8, morbidite ise %25 civarında olup striktür (%50), mediastinit, atrial fibrilasyon, perforasyon, plörezi, ciltte fotosensitivite gibi ciddi yan etkiler görülebilmektedir. Barrett metaplazisinin endoskopik tedavisinde umut verici termal yöntemlerden biri de argon plazma koagülasyonudur (BARRX). Bu yöntemde özel bir balon veya aplikatör kullanılmak suretiyle geniş Barrett alanları endoskopik olarak bir veya iki seansta tedavi edilebilirken çok düşük seviyede komplikasyon oranları bildirilmektedir.
Barrett özofagusu tedavisinde umut verici görünen bir tedavi şekli de sekelektif siklooksijenaz inhibitörlerinin kullanımıdır (COX-2). Kolon poliplerinde ve kolon ve özofagus kanseri gibi bazı kanser türlerinde olduğu gibi Barrett epiteli hücreleri de aşırı miktarda COX-2 oluştururlar. Hayvan ve insanlar üzerinde yapılan çalışmalarda refecoxib veya cefecoxib gibi selektif COX-2 inhibitörlerinin kullanılması ile Barrett epitelinde hücre proliferasyonunun, displazi gelişiminin ve kansere dönüşümün yavaşlatılabileceği veya önlenebileceği yönünde umut verici sonuçlar alınmaktadır.
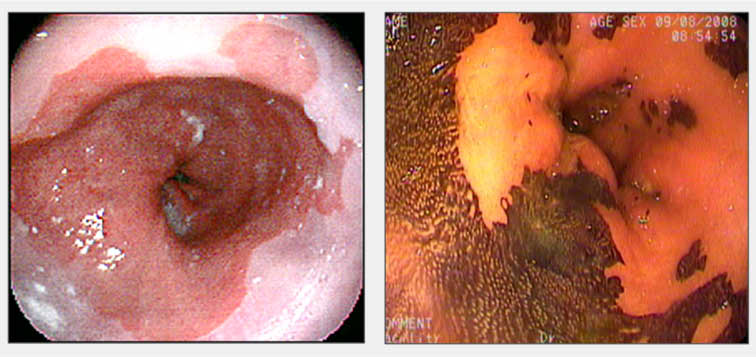
Barrett özefagusu nun endoskopik görünümü (Sağdaki resim %2 lugolle kromoskopi sonrasında çekilmiştir)
GÖRH nasıl tedavi edilmelidir?
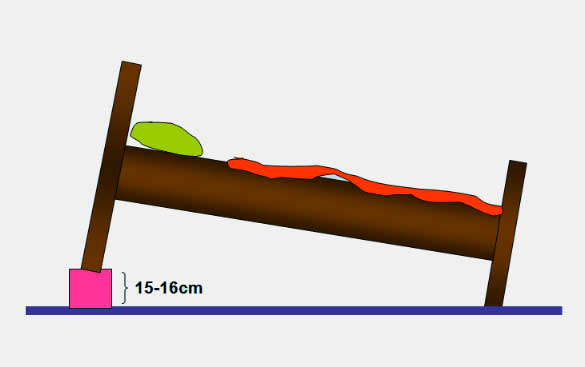
GÖRH da tedavinin amacı semptomların kontrol altına alınması, özofajitin iyileştirilmesi, komplikasyonların önlenmesi ve sağlanan remisyonun idamesidir. Hastalığın seyri değişik olabileceğinden her hastada farklı bir yaklaşım gerekir. Şikayetleri seyrek ve hafif olan vakalarda sadece antasit tedavisi yeterli olurken daha şiddetli vakalarda mide asit sekresyonunu baskılamaya yönelik tedavilere gerek duyulur. GÖRH kronik seyirli veya nükslerle giden bir hastalık olduğundan ilaç tedavisi ile birlikte hastaların yaşam tarzlarında yapabilecekleri bazı basit değişiklikler yönünden aydınlatılmaları gerekir (Yatak başının 15-17cm kadar yükseltilmesi, semptomları şiddetlendirebilecek gıdalardan sakınılması, yatmadan önce yemek yenmemesi, aşırı kiloların verilmesi, sigara ve alkol tüketilmemesi vb.)
Yaşam tarzında yapılması tavsiye edilebilecek değişiklikler
Yatak başucunun yükseltilmesi
Antasitler hızlı bir semptomatik düzelme sağlamakla birlikte genellikle bol miktarda ve sık aralıklarla kullanılmaları gerekir. Antasitlerin hafif GÖR vakalarında tek başlarına veya diğer tedavilere yardımcı olarak kullanılması tavsiye edilebilir.
Hafif vakalarda ve gastrointestinal sistemden absorbe edilmediği için özellikle gebelerde kullanılabilecek diğer bir ilaç aljinik asittir (Na-alginate-Gaviscon®). Aljinik asit tükürükteki bikarbonat ile reaksiyona girerek visköz bir yapıya dönüşerek mide içeriği üzerinde bir tabaka oluşturur ve böylece reflü anında mide içeriğinin özefagusa geçmesine engel olur. Özellikle gebelerdeki reflünün semptomatik tedavisinde yararlı olmaktadır.
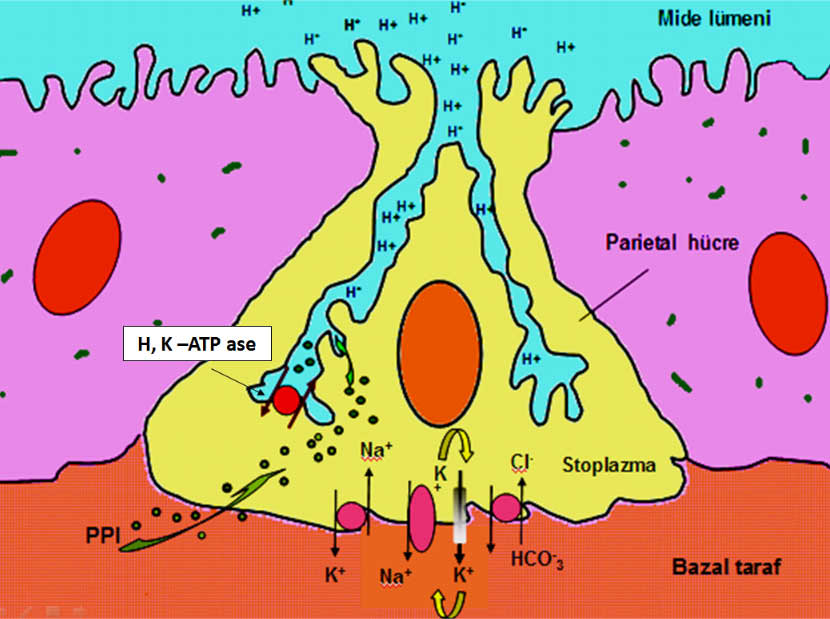
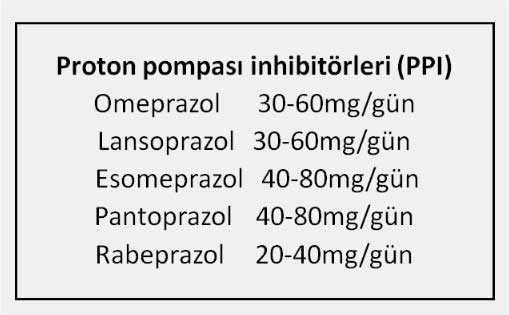
Mide asit sekresyonunun baskılanması GÖRH tedavisinde en önemli basamaklardan biridir. Bu amaçla hafif şiddetteki GÖR vakalarının tedavisinde tercih edilebilecek ilaç gurubu H2 reseptör blokerleri olabilir (Ranitidin,famotidin, nizatidin, roxatidin vb.). Duodenum ülseri tedavisinde H2 reseptör blokerleri gece yatmadan alınan tek dozda yeterli olurken GÖRH tedavisinde günde iki doz halinde ve daha yüksek miktarlarda kullanılması tavsiye edilmelidir (Ranitidin 2-3x150mg,Famotidin 2x40mg, Roksatidin 2x75mg. gibi). Uzun süreli kullanımda (>14 gün) tolerans gelişebildiğinden ilacın etkisi azalabilir. H2 reseptör blokerleri midede gece açlık salgısını daha iyi baskıladıklarından gece reflü semptomları ile uyanan hastalarda (nocturnal acid breakthrough) yatmadan önce alınmaları faydalı olmaktadır (2,6,7,31). Orta şiddette ve şiddetli GÖRH da kullanılması gereken ilaç gurubu proton pompası inhibitörleridir (PPI). (Omeprazol, lansoprazol, pantoprazol, rabeprazol, esomeprazol vb.). Plazma yarılanma ömürleri 1-2 saat kadardır ve tedaviye başlandıktan 2-3 gün sonra maksimum etkileri ortaya çıkmaya başlar. İlacın kesilmesinden sonra etkisinin tamamiyle ortadan kalkması için 4-7 gün gerekmektedir. Etki etmeleri için parietal hücrede aktive olmuş H+,K+-ATP ase gerektiğinden yemek sonrasında uyarılmış asit sekresyonunu baskılarlar ve bu nedenle yemekten 30-45 dk. önce alınmaları tavsiye edilir. Bu ilaçlar mide asit sekresyonunu güçlü bir şekilde (>%85) baskılarlar ve 8-10 haftalık bir tedavi sonrasında hastaların %83-95 inde iyileşme elde edilir. Aynı süre içinde H2 reseptör blokerleri kullanılması durumunda hastaların ancak %45-60 ında iyileşme sağlanabilmektedir. Gelecekte kullanılması düşünülen Tenetaprazol gibi yeni PPI leri daha güçlü ve uzun süreli etkileri nedeniyle (plazma yarılanma ömrü 7-11 saat ) asit baskılayıcı tedavide daha başarılı sonuçlar alınmasını sağlayacaktır. Yeni kullanılmaya başlanan diğer bir PPI türü ‘hızlı salınımlı PPI’ leridir (IR-Omeprazol, immediate release omeprazol). Bu ilaçlar alındıktan sonra 30dk içinde mide pH sını 6 nın üzerine çıkarabilmekte ve hızlı bir semptomatik düzelme sağlayabilmektedir.
Asit supresiv tedavide gelecekte kullanılması düşünülen diğer bir ilaç gurubu da ‘kompetetif potasyum kanal blokerleri‘dir (Revaprazan ve Soraprazan). Bu ilaçlar H+,K+-ATP ase ın potasyum taşıyıcı bölgesine kompetetif olarak bağlanarak etki gösterirler ve PPI lerinin aksine maksimum etkileri alınan ilk dozdan sonra ortaya çıkar. PPI den farklı olarak etki süreleri plazma yarılanma ömürleriyle orantılıdır ve ilacın kesilmesi ile antisekretuvar etki saatler içinde sona ermektedir (32).
Prokinetiklerin teorik olarak alt özefagus sfinkter (AÖS) basıncını artırarak, özefagusda peristaltik aktiviyeyi kuvvetlendirerek ve mide boşalımını hızlandırarak GÖR nün azalmasına katkıda bulunabilecekleri düşünülürse de pratikte GÖRH tedavisindeki faydaları sınırlıdır. Prokinetik ilaçlardan hiçbiri yalnız başlarına kullanıldıklarında distal özefagusdaki patolojik asit miktarını (pH 4 ün altında geçen süre) etkileyemediklerinden GÖRH nın tedavisinde tek başlarına kullanımları fayda sağlayamamaktadır. Reflü semptomları ile birlikte bulantı şikayeti olan ve mide boşalımı gecikmiş olan hastalarda asit supresiv tedaviye ilave edilebilirler. Metoklopramid, domperidon ve sisaprid bu amaçla kullanılabilecek ilaçlardır. Metoklopramid merkezi sinir sistemine (MSS) geçebildiğinden halsizlik,baş dönmesi, konfüzyon ve Parkinson hastalığına benzer bir tablo oluşturabileceğinden uzun süreli kullanım için uygun değildir. Domperidon MSS ne çok daha az miktarlarda geçtiğinden bu tür yan etkiler görülmez ancak hiperprolaktinemi yapabileceği unutulmamalıdır. Prokinetik ajanlar arasında AÖS basıncı ve özefagus peristaltizmi üzerinde en etkili olanı sisaprittir ancak QT mesafesini uzatarak ventriküler aritmilere yol açabildiğinden kullanımdan kaldırılmıştır. Özellikle makrolid gurubu antibiyotikler ve ketokonazolle birlikte kullanıldığında toksisitesi artmaktadır.
Mide parietel hücresinde PPI lerinin etki mekanizması
GÖRH tedavisinde önemli bir nokta tedavi kesildikten sonra hastaların büyük bir çoğunluğunda semptomların tekrarlamasıdır. 8-12 haftalık PPI tedavisinin kesilmesinden sonra hastaların %50’sinde 3 ay içinde, %80’inde de 6 ay içinde semptomlar tekrarlamaktadır. Bu nedenle hastaların çoğunda değişik yoğunlukda idame tedavisi gerekmektedir. İdame tedavisinde H2 reseptör blokerleri kullanılabilirse de birçok hastada PPI lerinin kullanılmasına gerek duyulur. GÖRH da tedavinin birden bire değil ilaç dozunun giderek azaltılarak ve gerekirse PPI den H2 reseptör blokerlerine geçilerek en az 6-8 haftalık bir sürede kesilmesi tavsiye edilir. Son yıllarda GÖRH nın idame tedavisinde hastaların belirli aralıklarla veya ihtiyaç duydukları zamanlarda (on demand) PPI kullanması şeklinde bir yaklaşımla iyi sonuçlar alınabileceği bildirilmektedir.
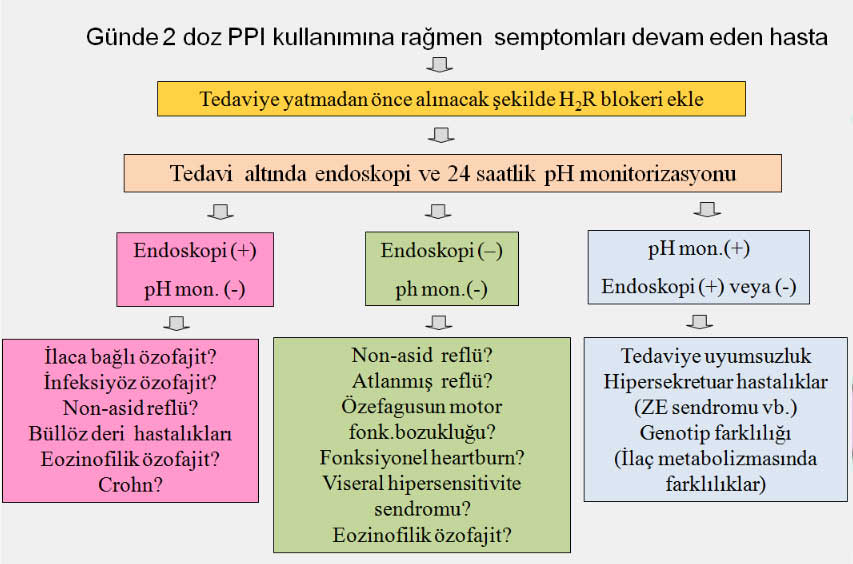
PPI tedavisine cevap vermeyen GÖRH da nasıl bir yol izlenmelidir?
Yeterli dozda asit supresiv tedaviye rağmen semptomatik olan hastalarda tedavi devam ederken 24 saatlik pH monitorizasyonu yapılmalıdır. İlaç kullandığı halde pH monitorizasyonunda asit reflüsü bulguları olan hastalar Zollinger Ellison sendromu yönünden araştırılmalı ve gerekirse cerrahi tedavi uygulanmalıdır. pH monitorizasyonu normal bulunduğunda ilaçlara veya enfeksiyöz ajanlara bağlı özofajit, eozinofilik özofajit, özofagusun motilite bozuklukları, viseral hipersensitivite sendromu ve fonksiyonel heartburn gibi diğer hastalıklar akla gelmelidir(2).
Yeterli dozda tedaviye rağmen düzelmeyen vakalarda neler yapılabilir?
Barrett özefagusu nasıl tedavi edilmeli ve izlenmelidir?
Aralıklı olarak asit pH (pH<4) ya meruz kalma Barrett epitelinde hücre proliferasyonunu belirgin ölçüde uyardığından kuvvetli asit supresyonu Barrett özefagusunda tedavinin temelini oluşturur. Barrett özefagusu olan hastalarda metaplazik epitelden alınan biyopsilerin sonucuna göre bir takip ve tedavi şekli uygulanır. Meteplazik epitelden 2 cm ara ile ve her dört kadrandan olmak üzere toplam 8 adet biyopsi alınmalıdır. Histopatolojik incelemede displazi yoksa hastanın PPI tedavisi ile 2-3 yılda bir endoskopik kontrolü yeterlidir. Hafif derecede displazi saptanan hastalarda PPI tedavisi altındayken ikinci endoskopi ilk yıl 6 ay ara ile tekrarlanmalı ve yine hafif displazi saptanması halinde hasta 1 yıl ara ile endoskopik kontrollere çağırılmalıdır. Ağır derece displazi saptanan hastalarda yoğun medikal tedavi sonrasındaki 3. ayda endoskopi tekrarlanmalı ve patolojik tanı başka bir patolog tarafından da doğrulandıktan sonra cerrahi rezeksiyonu uygulanmalıdır. Bazı merkezler bu hastaların yüksek doz PPI tedavisi altına alınarak 3 aylık aralıklarla endoskopik kontrolünü tavsiye etmektedir. Ağır displazi PPI tedavisi sonrasında nadiren gerileyebilir. Ağır displazi saptanan hastaların yaklaşık ½ ila 2/3 sinde tanı anında özefagusta zaten invaziv kanser bulunduğu gösterilmiştir. Rezeksiyonun mortalitesi %4-15 arasındadır. Cerrahiye kontrendikasyon teşkil eden durumların varlığında endoskopik mukozektomi, termal enerji (Lazer, multipolar elektrokoagülasyon, argon plazma koagülasyonu, endoskopik mukoza rezeksiyonu) ve fotodinamik tedavi yöntemleri denenebilir. Bunlar arasına en sık kullanılanlar fotodinamik tedavi yöntemleridir. Bu amaçla hastaya ‘hem’ biyosentezinde rol oynayan bir madde olan 5-aminolevulinic acid (5-ALA) veya bir hematoporfirin karışımı olan porfimer sodyum verildikten 4-6 saat sonra metaplazik epitele endoskopik olarak uygulanan laser epitelde biriken 5-ALA veya porfirini toksik forma dönüştürerek hücre ölümüne yol açar. Bu yöntemlerde başarı oranları %40 ile %90 arasında değişebilen oranlarda bildirilmekle birlikte mortalite %5-8, morbidite ise %25 civarında olup striktür (%50), mediastinit, atrial fibrilasyon, perforasyon, plörezi, ciltte fotosensitivite gibi ciddi yan etkiler görülebilmektedir. HGD saptanan Barrett metaplazisi endoskopik mukoza rezeksiyonu ile çıkarılabilir veya argon plazma koagülasyonu yapılarak ablasyon sağlanabilir. Bu konuda yöntemin etkinliğinin anlaşılmasına yönelik çalışmalar sürmektedir. Son yıllarda uygulanmaya başlanan etkili bir yöntem de endoskopik mukoza rezeksiyonudur. Barrett özefagusu tedavisinde umut verici görünen bir tedavi şekli de selektif siklooksijenaz inhibitörlerinin kullanımıdır (COX-2). Kolon poliplerinde ve bazı kanser türlerinde (kolon, özefagus, over vb.) olduğu gibi Barrett epiteli hücreleri de aşırı miktarda COX-2 oluştururlar. Hayvan ve insanlar üzerinde yapılan çalışmalarda refecoxib veya cefecoxib gibi selektif COX-2 inhibitörlerinin kullanılması ile Barrett epitelinde hücre proliferasyonunun, displazi gelişiminin ve kansere dönüşümün yavaşlatılabileceği veya önlenebileceği yönünde olumlu sonuçlar alınmaktadır. Reflü tedavisinde kullanılan ilaçların uzun süre kullanılmasının sakıncaları varmıdır? Uzun süreli PPI kullanımının oluşturduğu hipoklorhidri midede aşırı bakteri çoğalmasına, B12 vitamini ve demir emiliminin bozulmasına, H.pylori ile oluşan gastritin şiddetlenmesine sebep olabileceği gibi hipoklorhidrinin uyardığı hipergastrinemi mide fundusunda polip oluşumuna, parietal hücre hiperplazisine ve ECL (Enterocromaffin like cells) hücre hiperplazisi ve/veya gastrik karsinoid oluşumuna yol açabilir. İnsanlarda en az 10 yıl süre ile PPI kullanımına bağlı karsinoid tümör veya kolorektal kanser gelişimi bildirilmemiştir. Kolon kanseri insidensinde artma olabileceği ileri sürülmüşse de yapılan çalışmalarda böyle bir risk artışı olmadığı görülmüştür. 8-10 yıl süreyle PPI kullananlarda B12 vitamini eksikliği ve daha nadir olarakda demir eksikliği oluşabilir. Yağ, diğer vitaminler ve minerallerin eksikliğine rastlanmamıştır. Uzun süre PPI kullanan hastalarda pnömoni ve barsak enfeksiyonu ( özellikle hastanede yatan hastalarda C.difficili enfeksiyonu ) sıklığında hafif bir artış olabileceği bildirilmektedir. Cuomadin, benzodiazepin ve fenitoinle birlikte kullanımda ilaç etkileşimi olabilir ve bu ilaçların etkilerinde azalma görülebilir (26).
GÖRH tedavisinde endoskopik yöntemlerin yeri nedir?
Son yıllarda GÖRH nın tedavisinde bazı endoskopik tedavi yöntemleri kullanılmaya başlanmıştır. Tamamlanmış ve sürmekte olan çalışmalardan alınan erken sonuçlar yüz güldürücü olmakla birlikte halen daha bu yöntemlerin etkinlikleri kesin olarak kanıtlanmış değildir (4,6,7,21).
1- Radyofrekans enerji (Stretta yöntemi): Endoskopi sırasında gastroözofagial bileşke seviyesine yerleştirilen bir cihazla radyofrekans enerji verilmesi suretiyle dokuda kollajen birikimi ve kollajen kontraksiyonuna yol açarak zamanla AÖS basıncının artırılmasına yönelik bir tedavi şeklidir. Stretta yöntemi kullanılarak yapılan çalışmalarda bu tedaviden sonra hastaların yaklaşık % 60 ının ilaç kullanımına gerek duymadıkları veya sadece ihtiyaç hissettiklerinde ilaç kullandıkları tesbit edilirken son yıllarda yöntemin sanıldığı kadar etkin olmadığı ve uzun dönemde elde edilen faydanın plasebodan anlamlı olarak farklılık göstermediği anlaşılmıştır. Perforasyon ve işlem sırasında pulmoner aspirasyona bağlı ölüm bildirilmiştir.
2- EndoCinch (Endoskopik gastroplasti): Endoskopik yöntemle özofagogastrik bileşkeye bir çeşit dikiş koyularak bu bölgenin kese ağzı şeklinde büzülmesi ve mukozada ilave kıvrımlar oluşturulmasına yönelik bir tedavi şeklidir. Tedavi sonrasındaki 2.yılda hastaların %25 inin ilaç kullanımını tamamiyle bıraktıkları, %30 unun kullandıkları ilaç dozunu yarıdan fazla bir oranda azalttıkları, hastaların %45 inde tam dozda medikal tedaviye ihtiyaç duyulduğu bildirilmiştir. Pratikte sık tercih edilen bir yöntem değildir.
3- Alt özefagus sfinkterinin güçlendirilmesine yönelik yöntemler: AÖS bölgesine pleksiglas mikrosfer veya etilen vinilalkol polimer (Enteryx) partikülleri gibi bazı maddelerin enjekte edilmesiyle sfinkter mekanizmasının güçlendirilmesine yönelik bir tedavi yöntemidir. Enteryx tedavisinden sonraki 2.yılda hastaların %75 inin tedaviyi bıraktıkları veya ilaç dozunu azalttıkları bildirilmiştir. Aort peforasyonu ve mediastinit gibi ölümcül komplikasyonları nedeniyle kullanımdan kaldırılmıştır.
Endoskopik yöntemlerin etkinlikleri henüz tam olarak açıklığa kavuşmadığından ve uygulama sırasında hastanın kaybedilmesine kadar varabilecek ciddi yan etkiler oluşabildiğinden ancak seçilmiş vakalarda, iyi bir değerlendirme sonrasında ve tecrübeli endoskopistler tarafından uygulanmalarına müsaade edilmelidir.
Gebelerde reflü tedavisi nasıl olmalıdır?
Gebelik GÖRH nın en sık görüldüğü redispozan sebeplerden biridir. Gebe kadınların %25 inde hergün en az bir kez heartburn olmaktadır. Gebelikte reflü tanımlayan hastaların ancak %20-25 inin gebelik öncesinde reflü şikayeti olduğu anlaşılmıştır. Reflü sıklığı ve şiddeti gestasyonel peryodla artar (1.trimestrde %22, 2.trimestrde %39, 3.trimestrde %72) ve gebelik sonrasındaki günler içinde normale döner. Hastaların %50 si 1. trimestrde, %40 ı da 2.trimestrde semptomatik hale gelirler. Gebelik sırasında oluşan hormonal değişiklikler nedeniyle AÖS basıncı azalmakta ve bu azalma gebelik süresi ilerledikçe daha belirgin hale gelmektedir. Ayrıca büyüyen uterus nedeniyle karın içi basıncının artışı da reflü oluşumuna katkıda bulunan bir faktördür. Anemnez çoğu kez tanı için yeterlidir. Endoskopi ve pH monitorizasyonu gebelerde güvenle kullanılabilecek yöntemlerdir. Endoskopi sırasında sistemik premedikasyonda kullanılan opioidler fötusa zararlı olabileceğinden lokal anestezi ile yetinilmelidir. Radyolojik yöntemlerin kullanılması kontrendikedir. Gebelikte GÖRH tedavisi genel popülasyondan farklıdır. Hastaların bir kısmında (%25-50) ında yaşam tarzında ve diyette yapılan değişikliklerle yeterli sonuç alınabilir (Bkz. GÖRH tedavisi). Bu tür önlemlerle yeterli fayda elde edilemeyenlerde bazı antasitler, aljinik asit (Gaviscon) ve gerektiğinde sucralfate tedavide kullanılabilecek ilaçlardır. Sodyum içeren antasitler sıvı yüklenmesine, aleminyumlu antasitler fötal toksisiteye yol açabilirler. Gebeliğin son döneminde kullanılacak magnezyumlu antasitler doğumu yavaşlatabilirler. Hastaların %50-80 ninde aljinik asit, sucralfat ve antasitlerle veye bunların kombinasyonları şeklinde uygulanacak bir tedavi ile iyi sonuç alınmaktadır. Gebelerde H2 reseptör blokerlerinin güvenli olduğuna dair kesin veriler olmadığından bu ilaçların gebelik süresince kullanılması tavsiye edilmez. Nizatidin’in hayvan deneylerinde fötusa toksik etkisi olduğu gösterilmiştir. Son yıllarda yapılan çalışmalar PPI lerinin gebelik sırasında kullanımının güvenli olduğunu ve bu ilaçların kulanıldığı gebeliklerdeki major fötal anomali gelişme riskinin diğer gebeliklerden farklı olmadığını göstermiştir. PPI kullanan gebelerde major fötal anomali gelişme riski omeprazol ve lansoprazol kullanılan guruplarda sırasıyla %3.6 ve 3,9 iken plasebo gurubunda %3.8 bulunmuştur. Prokinetik ajanlar uterus kontraksiyonlarına yol açabilirler ve fetusa toksik etki gösterebilirler(1,7,6,26).
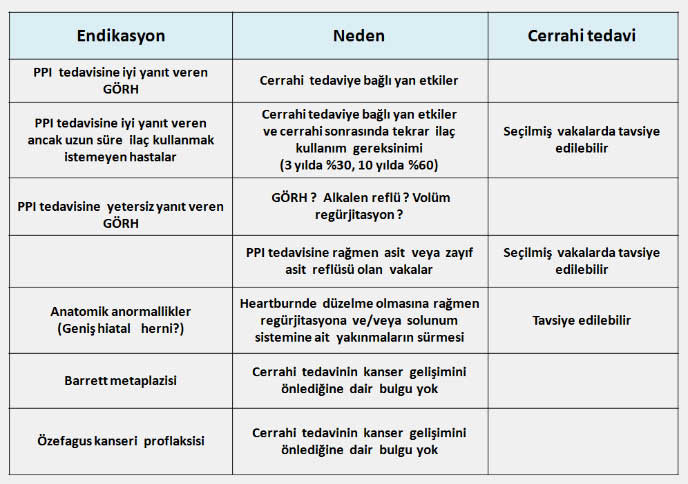
GÖRH da cerrahi tedavi endikasyonları
GÖRH da cerrahi tedavi ne zaman uygulanmalıdır?
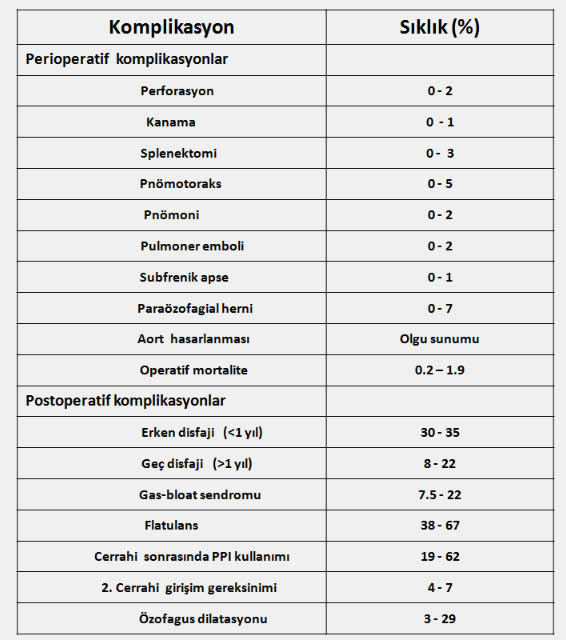
Medikal tedaviye rağmen GÖR hastalarının yaklaşık %10-15 kadarında cerrahi tedaviye gerek duyulur. Medikal tedaviye yanıt vermeyen şiddetli özofajit, hemorajik özofajit veya solunum sistemine ait semptomların varlığı cerrahi tedavi gerektirir. GÖRH ile birlikte hitaus hernisi olan genç ve orta yaşlı hastalarda devamlı ilaç kullanım gereksinimi göz önünde bulundurularak cerrahi tedavi önerilebilir. Barrett özefagusu displazi gelişmedikçe tek başına cerrahi tedavi için bir endikasyon oluşturmaz ve cerrahi tedavi kanser gelişme riskini azaltmaz. Endoskopik dilatasyona yanıt vermeyen peptik darlıklar cerrahi olarak tedavi edilmelidir. Cerrahi tedavide uygulanan yöntem değişik formlarda olabilen fundoplikasyondur (Nissen fundoplikasyonu). Son yıllarda, laparoskopik yöntemler kısa sürmesi, hastanede kalma süresini kısaltması ve hastaya daha az zarar vermesi nedeniyle klasik açık ameliyatlara tercih edilmeye ve tecrübeli ellerde oldukça iyi neticeler alınmaya başlanmıştır (Laparoskopik Nissen Fundoplikasyonu – LNF). LNF sonrasında 1-3 ay kadar sürebilen geçici disfaji olabilir. Doğru endikasyonla yapıldığında cerrahi tedavi sonrasında reflü semptomları ve ilaç kullanma gereksinimi ortadan kalkar. Ancak uzun dönemde değerlendirildiğinde fundoplikasyondan 5 yıl sonra hastaların %25 inde, 10 yıl sonra ise yarıdan fazlasında tekrar değişik dozlarda ilaç tedavisine ihtiyaç duyulduğu anlaşılmıştır. LNF sırasında dalak rüptürü, özefagus perforasyonu vb. komplikasyon görülme oranı %1,5, mortalite ise %0,5-0,8 civarındadır ki bu risk herhangi bir reflü hastasının hayatı boyunca yemek borusu kanserine yakalanma riskinden (%0,002-0,035) belirgin olarak daha yüksektir (2,6,26,33). Bu nedenlerle gastroözofagial reflü hastalığında cerrahi tedavi için acele edilmemesi ve cerrahi tedaviye karar vermeden önce hastanın yaşı, klinik bulguları, hiatal herni varlığı, ilaç tedavisine alınan yanıt ve diğer tıbbi problemlerin varlığı gibi değişik faktörlerin birlikte değerlendirilmesi gerekir.
Cerrahi tedavinin komplikasyonları
Kaynaklar
1- Long JD,Orlando RC: Esophagus. Sleisenger M, Friedman LS (Eds): Gastrointestinal and liver disease. Saunders,New York,2002,s:551-671.
2- Orlando RC,Dobrucali A: Gastroesophageal reflux disease. Feldman M, Orlando RC (Eds): Atlas of esophageal disease. Current Medicine,Philadelphia,2002,S: 91-116.
3-Kulig M, Leodolter A, Vieth M, et al. Quality of life in relation to sympoms in patients with gastroesophageal reflux disease – an analysis based on the proGERD initiative. Aliment Pharmacol Ther 2003;18:767-776.
4- Wiklund I. Review of the quality of life and burden of illness in gastroesophageal reflux disease. Dig Dis 2004;22:108-114.
5- Orlando RC. Current understanding of the mechanism of gastroesophageal reflux disease. Drugs 2006;66 Suppl.1;1-5.
6- Dobrucalı A. Özofagus hastalıkları. İç Hastalıkları-Cerrahpaşa. Ed: Hamuryudan V,Sonsuz A.İstanbulMedikal Yayıncılık,İstanbul, 2005,S:742-782
7- Fass R,Wong WM. Gastroesophageal reflux disease. In: Clinical Gastroenterology and Hepatology. Eds: Weinstein W, Hawkey CJ,Bosch J. Elsevier-Mosby,Spain,2005,pp:157-178.
8- Richter JE: Esophagus. Brandt LJ (Ed): Clinical Practice of Gastroenterology.Churchill Livingstone,1999,S:2-150.
9- Heading RC, Castell DO. Clinical spectrum and diagnosis of gastroesophageal reflux disease. In:The Esophagus.Eds: Castell DO,Richter JE. LW&W company,Philadelphia,4’th edition,2004,pp: 381-388.
10- Jaspersen D,Kulig M,Labenz J, et al. Prevalence of extraesophageal manifestations in gastroesophageal reflux disease: an analysis based on the proGERD study. Aliment Pharmacol Ther 2003:17:1515-1520.
11- Irwin RS,Curley FJ,FrenchCL. Chronic cough.The spectrum and frequency of causes, key components of the diagnostic evaluatiun and outcome of spesific therapy. Am Rev Respir Dis 1990;141:640-647.
12- Field SK, Suherland LR. Does medical antireflux therapy improve asthmatics with gastroesophageal reflux? A critical review of the literature Chest 1998:114;275-283.
13- Gibson PG,Henry RL,Coughlan JL. Gastroesophageal reflux treatment for asthma in adults and children. Cochrane Database Syst Rev 2003;2: CD001496. 1
4- Kirk AJ. Reflux dyspareunia. Thorax 1986;41:215. Pace F, Bollani S,Molteni R, et al. Natural history of gastroesophageal reflux disease without esophagitis (NERD) – a reappraisal 10 years on. Dig Liver Dis 2004;36:111-115
15- Fass R,Fennerty MB,Vakil N. Nonerosive reflux disease – current concepts and dilemnas.Am J Gastroenterol 2001;96:303 -314.
16- Dean BB, Gano AD,Knight K, et al. Effectiveness of PPI in nonerosive reflux disease. Clin Gastroenterol Hepatol 2004;2:656-664.
17- Castell DO.Mainie I,Tutuian R. Non-acid gastroesophageal reflux: Documenting its relationship to symptoms using miltichannel intraluminal impedance (MII). Transactions of American clinical and climatological association, 2005;116:321-333.
18- Galmiche JP. Non-erosive reflux disease and atypical gastroesophageal reflux disease manifestations: Treatment results. Drugs 2006;66 suppl 1:7-13.
19- Wang WH, Huang JO, Zheng GF, et al. Is proton pump inhibitor testing an effective approach to diagnose gastroesophageal reflux disease in patients with noncardiac chest pain? A meta analysis. Arch Intern Med 2005;165:1122-1128
20- Breumelhof R, Nadorp JH, Akkermans LM,Smout AJ. Analysis of 24 hour esophageal pressure and pH data in unselected patients with noncardiac chet pain. Gastroenterology 1990;99:1257-1264.
21- DeVault KR,Castell DO. Updated guidelines for the diagnosis and treatment of gastroesophageal reflux disease.Am J Gastroenterol 2005;100:190-200.
22- Shay S, Sifrim D,Tutuian R, et al. Multicahnnel intraluminal impedance (MII) in the evaluation of paients with persistent GERD symptoms despite PPI: a multicenter study Gastroenterology 2003: 124 suppl.1 A-537. 23- Fass R,Fennerty MB,Ofman JJ, et al. The clinical and economic value of a short course of omeprazole in patients with noncardiac chest pain. Gastroenterology 1998;115:42-49.
24- Ruigomez A,Rodriguez LA,Wallander Ma, et al. Natural history of gastroesophageal disease diagnosis in general practice. Aliment Pharmacol Ther 2004;20:761-760.
25- Nasi AJ, Moraes FB,Zilberstein B, Cecconella I, Rodrigues JG, Pinotti HW. Gastroesophageal reflux disease: clinical, endoscopic, and intraluminal esophageal pH monitoring evaluation. Diseases of the Esophagus, Volume 14, Issue 1: 41-49.
26- Acid Peptic Disease of the Esophagus. In: DDSEP lV Syllabus. Ed: Chang EB. Kendall publishing company,USA,2004,pp:1-23.
27- Falk GW. Barrett’s esophagus. Gastroenterology 2002;122:1569-1591.
28- Rex DK, Cummings OW, Shaw M, et al. Screening for Barrett’s esophagus in colonoscopy patients with and without heartburn. Gastroenterology 2003;125:1670-1677.
29- Amano Y, Ishimura N,Furuta K,et al. Which landmark results in a more consistent diagnosis of Barrett’s esophagus, the gastric folds or the palisade vessels? Gastrointestinal Endoscopy 2006;64:2:206-211.
30- Sharma P,Dent J,Amstrong D, et al. The development and validation of an endoscopic grading system for Barrett’s esophagus: The Prague C&M criteria. Gastroenterology 2006;131:1392-1399.
31- Dent J,BUrn J,Fendrick AM,et al. An evidence based appraisal of reflux disease management – the Genval Workshop Report. Gut 1999;44 suppl 2:1-
32- Carmelo S,Pelonisini I,Mario F. Acid suppression therapy:Where do we go from here? In:Recent advances in gastrointestinal pharmacology and therapeutics Eds: Scarpignato C,Mario F. Karger, NY, 2006, S:11-73. 33- Richter JE. Let the patients beware: the evolving truth about laparoscopic antireflux surgery. Am J Med 2003;114-71-73.